Zeitgeist: Moving Forward (2011)
Valtava uutinen, D-Friends: uusi nopeasti vaikuttava hengittävä insuliini nimeltä Afrezza on juuri saanut FDA: n hyväksynnän!
Kolmas kerta on hurmaava uusi inhalaatiosolulinjan formulaatio, toinen, joka on tehnyt sen Yhdysvaltain sääntelyprosessin jälkeen, kun Pfizerin epäonnistunut Exubera oli paremman osan kymmenen vuotta sitten.
Perjantaina Kalifornian biotekniikan yritys MannKind Corp. sai vihdoin sääntelytilin Afrezza-laitteelle.

Nyt kun Afreza lähetettiin uudelleen lokakuussa 2013, MannKind on vihdoin vakuuttunut FDA: sta, että se on valmis pääsemään diabeteksen aikuisten käsiin!
MannKindin ylimmän johdon kerrotaan meille, että he pyrkivät löytämään lääkekumppanin Afrezzan valmistamiseen ja jakeluun, ja tuote voidaan saattaa käyttöön tammikuun tai vuoden 2015 ensimmäisen neljänneksen loppuun mennessä. > Perjantaina julkaistussa FDA: n lehdistötiedotteessa lääkäreiden aineenvaihdunnan ja endokrinologian tuotteiden osaston johtaja Jean-Marc Guettier toteaa: "Tämän päivän hyväksyntä laajentaa käytettävissä olevia vaihtoehtoja ruoansulatuskanavan insuliinin tuottamiseen diabetesta sairastavien potilaiden yleisessä hoidossa, jotka tarvitsevat sitä verensokerin säätelyyn. "
Afrezza on 411 Afrezzalle, niille, jotka eivät tiedä:Afrezza on ultraviolettivapaa insuliini jauheena, joka on suunniteltu ennen aterian insuliinia aikuisille (ei vielä lapsille ) tyypin 1 tai tyypin 2 diabeteksen kanssa. Se on tarkoitettu aterian jälkeiseen verensokeriin, mikä tarkoittaa sitä, että sitä käytetään nykyisen insuliinihoidon kanssa eikä ole tarkoitettu erilliseen insuliinihoitoon.
Jauhemaista insuliinia annostellaan Whistle-kokoisen inhalaattorin kautta nimeltä Dreamboat, joka kehitettiin ensimmäisen FDA-kierroksen jälkeen ja aiheutti viivästyksiä, koska virasto halusi uusia kliinisiä tutkimuksia käyttäen uutta inhalaattoria. Jauhe liukenee välittömästi sisään hengitettynä keuhkoihin, ja insuliini on sitten nopeasti laskenut verenkiertoon, jotta se alkaa toimia. Afreza huipentuu 12-15 minuutin kuluessa ja se on pois järjestelmästä tunnin sisällä verrattuna nykyisiin lyhytaikaisiin insuliineihin, jotka yleensä kestää vähintään 20 minuuttia potkia, huippua 2-3 tuntia, ja voivat pysyä järjestelmässä jopa viisi tuntia.
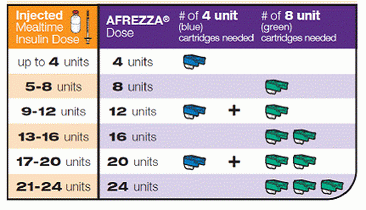
Tietenkin suurin haaste on se, että se ei vaadi neuloja, vaan vain pieni kädessä pidettävä inhalaattori, joka todella näyttää pilliin.Dreamboat on tarkoitus heittää pois 15 päivän kuluttua estääkseen minkä tahansa sisäisen jauheen muodostumisen, joka voi tukkia laitteen. Toisin kuin perinteisessä insuliinissa, se ei vaadi jäähdytystä, vaan se pidetään huoneenlämmössä. Jokainen kertakäyttöinen patruuna säilyttää joko 4 tai 8 yksikköä, ja Afrezzaa kaupallistettaessa saattaa olla 12 yksikköpatruuna.
Näin voit antaa sen, muuttaa nykyisen insuliiniruiskutuksen tai bolusmäärät Afrizzan-ystävälliseksi hengitettäviksi annettavaksi annokseksi:
Henkilökohtaisesti, että ei näytä paljon insuliinia kattamaan joitain aterioita, joita syön vaativat suurempia annoksia … olisin menossa läpi joukon pieniä patruunoita. Niinpä joidenkin PWD-laitteiden tapauksessa tämä laite voi olla logistinen haaste, kun pystymme helposti antamaan tarvittavat määrät …? Mutta sitten taas tämä voi olla hyvä keino lyödä itsepäisiä korkean veren sokereita korjausannostuksella.
MannKindin presidentti Hakan Edstrom kertoi puhelinkeskustelussa perjantaina perjantaina, että yritys ei ole vielä viimeistellyt mahdollisia kumppaneita mahdollisten kumppanien kanssa Afrezzan valmistajaksi ja jakeluksi. Mutta se lähestyy ja neuvottelee useiden yritysten kanssa viimeistelemällä kumppanuuden mahdollisimman pian.
Kustannukset pysyvät TBD: ssä (paljon riippuu mahdollisesta kumppanuudesta), mutta Edstrom sanoo odottavansa hintojen olevan samassa määrin kuin mitä potilaat maksavat nyt insuliinikynsiä YhdysvalloissaTämä hyväksyntä on valtava kehitystyö, ja on kulunut kauan, kahdeksan vuotta siitä lähtien, kun Alfred Mann aloitti tämän etsinnän. Hän on perustanut Minedin ennen kuin se lopulta osti Medtronicin. Olemme seuranneet Afreza-tarinaa vuosia täällä "
Kaivos - alkuperäisestä FDA: n arkistopäivästä, jolloin MannKind oli alun perin suunniteltu, jotta viimeisimmät tiedot siitä, miten Afrezzaa käytetään keinotekoisessa pankreasissa kliinisiä tutkimuksia.
Ennen viime vuoden FDA: n uudelleen lähettämistä kuulemme, että MannKind ylpeilee sen vaiheen III kliinisistä tutkimuksista, jotka sisälsivät 500+ tyypin 1 päihdetyötä Yhdysvalloissa ja maailmanlaajuisesti, mikä osoitti, että yritys oli valmis kokeilemaan kättä uudelleen FDA: n kanssa.
Tämän vuoden huhtikuun 1. päivänä kokoontunut neuvoa-antava komitea äänesti 13: stä 1: lle, että Afrezza oli turvallinen ja tehokas hyväksyttäväksi tyypin 1 diabeteksen hoitoon, ja yksinhuoltajana David Cooke äänesti, että riskit ylittivät tyypin 1s.Hän osoitti sisäisen FDA: n tarkistuksen, että jotkut potilaat ottavat Afrezzaa lopettamaan hoidon, kun keuhkoputkien, yskä ja keuhkojen toiminta heikkenivät. Mikään näistä huolenaiheista ei kuitenkaan ilmennyt Afrežan äänestyksessä tyypin 2 käytöstä, ja valiokunta päätti yksimielisesti 14-0 äänestä.

Sitä ei suositella tupakoimattomille eikä Diabeettisen ketoasidoosin (DKA) hoitamiseksi.
Afreza on hyväksytty vain aikuisille, ei lapsille. Virasto kuitenkin pyytää markkinoille saattamista koskevaa kliinistä tutkimusta turvallisuuden ja käytön arvioimiseksi lapsipotilaille.
- FDA vaatii Boxed Warning -toimintoa, joka kertoo, että jotkut ihmisillä, joilla on Afrezaa käyttänyt astma ja krooninen obstruktiivinen keuhkosairaus (COPD), ovat kokeneet akuutin bronkospasmin. Tämän seurauksena niillä, joilla on krooninen keuhkosairaus, astma tai COPD, ei pitäisi käyttää Afrezaa tämän riskin vuoksi. Afrezzaan liittyvät yleisimmät haittavaikutukset kliinisissä tutkimuksissa olivat hypoglykemia, yskä ja kurkun kipu tai ärsytys.
- Osa hyväksyntävaatimuksista on riskinarviointi- ja lieventämisstrategia, johon on sisällyttävä viestintäsuunnitelma, jonka avulla terveydenhuollon ammattilaisille tiedotetaan Afrezaan liittyvästä akuutin bronkospasmin vakavasta vaarasta. Näin varmistetaan, että hyödyt ovat suurempia kuin Afrezzin käytön mahdolliset riskit.
- Afrezaan tarvitaan muita markkinoille saattamisen jälkeisiä tutkimuksia, kuten kliinistä tutkimusta keuhkosairauden mahdollisen riskin arvioimiseksi käytön aikana (tämä koe arvioi myös kardiovaskulaarisen riskin ja Afrezan pitkän aikavälin vaikutuksen keuhkofunktioon); ja kaksi farmakokineettistä farmakodynaamista euglykeemistä glukoosipitoista kliinistä tutkimusta, yksi annosvasteen karakterisoimiseksi ja yksi ominaisuuksien vaihtelevuuden karakterisointi.
- Edstrom kertoi aikovansa aloittaa pediatriset tutkimukset mahdollisimman pian, mikä alkaa realistisesti jo vuoden 2015 puolivälissä. Tämä tarkoittaa sitä, että Afrezaa ei ehkä hyväksytä diabetesta sairastaville lapsille vuoteen 2017 saakka, ja että sääntelyprosessi voi vaihdella sen mukaan, mitä markkinoiden jälkeiset tutkimukset ja aikuisten käyttökokemukset osoittavat tällä välin.
- Ja huolimatta FDA: n vihreästä valosta, ei ole takeita Afreza näkee kaupallista menestystä tai että PWD: t parantavat sen käyttöä. Kuten totesi, MannKind ei ole vielä varmistanut lääkkeitä, jotka ovat valmiita myymään Afrezaa. Mutta jos MannKindin tulot kutsuvat toukokuussa, on viitteitä siitä, mitä on tulossa pian, mahdollinen kumppanuus ei välttämättä ole kaukana.
Sijoittajan näkökulmasta monet ovat skeptisiä epäonnistuneen Exubera-inhaloidun insuliinin perusteella, joka on muuttanut Afreza-keskustelua viime vuosien aikana. Kyseinen Pfizer-Sanofi -yhtiön tuote irrotettiin markkinoilta vuonna 2007 yli yhden vuoden myynnin jälkeen - mikä johti ennätykselliseen 2 dollariin. 8 miljardin tappion myyjille.
Tietenkin MannKind väittää, että Afreza on merkittävästi erilainen, lähinnä siksi, että Exubera käytti ankaraa jalkaista inhalaattoria ja liittyi korkeampaan keuhkosyöpään, että Pfizer ei juuri voinut voittaa.
Näemme, mitä D-yhteisö ajattelee nyt Afrezzan kanssa, varsinkin kun kaikki AP: n kliiniset tutkimukset ovat kiinnittäneet huomiota viime aikoina. Riippumatta siitä, riittää massoja vakuuttamaan, on vielä epäselvä …
Hengittävät uutisia nyt, ja näemme, kuinka kauan meidän kaikkien on hengitettävä ja käännettävä tämä jännitys todelliseksi myynniksi ja laajalle käytölle.
Vastuuvapauslauseke
: Diabetes Mine -ryhmän luoma sisältö. Lisätietoja saat klikkaamalla tästä.
Vastuuvapauslauseke Tämä sisältö on luotu Diabetes Mine -verkostoon, joka on diabetesta käsittelevä yhteisö. Sisältöä ei ole tarkistettu lääketieteellisesti eikä se noudata Terveysalan toimituksellisia ohjeita. Lisätietoja Terveysn yhteistyöstä Diabetes Mine -yrityksen kanssa saat napsauttamalla tästä.Diabetes Uutiset: Dexcom SHARE saa FDA: n hyväksynnän!

Langaton Bluetooth Dexcom SHARE -järjestelmä on saanut FDA: n. Dexcom SHARE mahdollistaa CGM: n tietojen lähettämisen älypuhelimeesi.
Inhaloitu insuliini Afrezza on saanut FDA: n hyväksynnän

FDA hyväksyi uuden inhaloidun insuliinituotteen. Afrezza on ultrapapiditekninen jauhemuotoinen insuliini, joka on suunniteltu ennen ateriaa tyypin 1 diabeetikoille.
Afrezza, afrezza 4 yksikköä (30) - 8 yksikköä (60), afrezza 4 yksikköä (60) - 8 yksikköä (30) (insuliini (inhalaatio)) haittavaikutukset, vuorovaikutukset, käyttö ja lääkejälki

Huumeita koskevat tiedot Afrezzalla, Afrezza 4 yksikköä (30) - 8 yksikköä (60), Afrezza 4 yksikköä (60) - 8 yksikköä (30) (insuliini (inhalaatio)) sisältää lääkekuvia, sivuvaikutuksia, lääkkeiden yhteisvaikutuksia, käyttöohjeet, yliannostuksen oireita ja mitä välttää.


